Visualisierung der elektrischen Aktivität neuronaler Netzwerke - eine erfolgversprechende Methode für die psychiatrische Grundlagenforschung
Forschungsbericht (importiert) 2010 - Max Planck Institut für Psychiatrie
Das menschliche Gehirn – ein extrem komplexes Netzwerk aus Nervenzellschaltkreisen
Aus naturwissenschaftlicher Sicht resultieren psychiatrische Störungen aus krankhaft veränderten Funktionsweisen des Gehirns, dessen grundlegender funktioneller Baustein die Nervenzelle oder das Neuron ist (Abb. 1). Ein Charakteristikum dieses hoch spezialisierten Zelltyps ist seine Fähigkeit, elektrische Signale zu generieren. In Wirbeltiergehirnen verschalten sich Neurone über spezielle Kontakte (chemische Synapsen) zum Zwecke interneuronaler Kommunikation zu extrem komplexen Netzwerken (Abb. 1). Es ist letztendlich die elektrische Aktivität dieser Hirnschaltkreise, die Verhaltensweisen und Emotionen hervorbringt und kontrolliert.

Das menschliche Gehirn ist wahrscheinlich das komplexeste System im Universum. Um dies zu veranschaulichen, seien folgende Zahlen und Fakten genannt: Das Gehirn eines erwachsenen Menschen enthält in etwa 100 Milliarden Nervenzellen, von denen jede einzelne durchschnittlich 1.000 chemische Synapsen zu anderen Neuronen ausbildet. Darüber hinaus ist die Übertragungsstärke der elektrischen Nervenzellsignale an den daraus resultierenden ca. 100 Billionen chemischen Synapsen nicht fixiert. An den chemischen Synapsen werden, abhängig vom Neuronentyp, unterschiedliche Überträgerstoffe (Neurotransmitter) ausgeschüttet (z.B. Glutamat, γ-Aminobuttersäure, Serotonin und Dopamin). Die synaptische Übertragungsstärke kann beispielsweise durch veränderte Neurotransmitterkonzentrationen, aktivitätsabhängige Prozesse (synaptische Plastizität) sowie zahlreiche endogene und exogene Substanzen (Neuromodulation) kurz- oder langandauernd erhöht oder abgeschwächt werden. Neben der synaptischen Plastizität weist das Gehirn noch weitere Plastizitätsformen auf, z.B. die strukturelle Plastizität, die gemeinsam mit der synaptischen Plastizität unter dem Begriff Neuroplastizität subsumiert werden. Aufgrund der geschilderten strukturellen und funktionellen Eigenschaften des Gehirns kann man davon ausgehen, dass Veränderungen des Flusses elektrischer Nervenzellaktivität durch Hirnschaltkreise eine ursächliche Rolle bei der Entstehung psychiatrischer Krankheiten spielen.
Die Erforschung der Kausalmechanismen psychiatrischer Krankheiten ist eine Grundvoraussetzung für Hypothesen-gesteuerte Entwicklungen effektiverer Behandlungsformen. Somit erscheint es äußerst wichtig, Veränderungen der neuronalen Netzwerkaktivität und der synaptischen Kommunikation zwischen Nervenzellen im Gehirn aufzudecken, die maßgeblich an der Entstehung von Kernsymptomen dieser Krankheiten beteiligt sind. Die vor kurzem am Max-Planck-Institut für Psychiatrie gegründete Arbeitsgruppe „Dynamik neuronaler Netzwerke“ widmet sich dieser Aufgabe und richtet hierbei ihr Augenmerk vor allem auf Depression und Angsterkrankungen. In enger Kooperation mit anderen Arbeitsgruppen am Institut setzen Matthias Eder und sein Team hierzu, neben anderen elektrophysiologischen Techniken, ein modernes bildgebendes Verfahren (High-Speed Voltage-Sensitive Dye Imaging) ein, das es ermöglicht, Veränderungen des Flusses elektrischer Nervenzellaktivität in Hirnschaltkreisen darzustellen.
High-Speed Voltage-Sensitive Dye Imaging
Die elektrische Aktivität von Neuronen spiegelt sich in Veränderungen ihres Membranpotenzials wider. Dieser Vorgang kann mittels klassischer Mikroelektroden-Techniken gemessen werden. Will man jedoch den Fluss elektrischer Nervenzellaktivität durch ganze Hirnschaltkreise untersuchen, sind diese Methoden ungeeignet. Eine elegante moderne Technik, die die Einschränkungen umgehen kann, ist das High-Speed Voltage-Sensitive Dye Imaging (VSDI). Die technische Realisierung dieser Methode ist kompliziert, das grundlegende Prinzip jedoch einfach. Fluoreszierende Farbstoffe, die sich in die Zellmembran von Neuronen einlagern, bilden Veränderungen des Membranpotenzials durch die Stärke des ausgestrahlten fluoreszierenden Lichts ab. Dieses Phänomen kann mit einer räumlich und zeitlich hochauflösenden Kamera gemessen werden (räumliche Auflösung im Mikrometerbereich, zeitliche Auflösung im Millisekundenbereich). Mittels VSDI kann somit die Ausbreitung elektrischer Nervenzellaktivität in ganzen Hirnregionen visualisiert und quantifiziert werden. Obwohl VSDI an oberflächennahen Hirnstrukturen prinzipiell auch am lebenden Tier realisiert werden kann, müssen Experimente in tiefer gelegenen Hirnstrukturen an Hirnschnittpräparationen durchgeführt werden. Die Schwierigkeit dieses Ansatzes besteht darin, die entsprechenden neuronalen Netzwerke sowohl strukturell als auch funktionell zu erhalten.
VSDI weist Veränderungen neuronaler Netzwerkaktivität durch das Stresshormon CRH nach
Der Arbeitsgruppe von Matthias Eder ist es gelungen, ein Hirnschnittpräparat von Mäusen herzustellen, das es erlaubt, mittels VSDI den neuronalen Aktivitätsfluss durch den ganzen Hippokampus zu studieren (Abb. 2). Der Hippokampus zählt zu den evolutionär ältesten Strukturen des Gehirns, spielt eine wichtige Rolle für Lernen und Gedächtnis und ist für die Entstehung von Depression und Angsterkrankungen relevant. Diese Erkrankungen stehen eng mit Stress in Verbindung. Daher wurde in einem ersten VSDI-Projekt untersucht, inwieweit das Stresshormon CRH (Corticotropin-Releasing Hormone) hippokampale Netzwerkaktivität beeinflusst. Das Neuropeptid CRH wird im Gehirn während physischem und psychischem Stress im Hypothalamus, aber auch direkt von Nervenzellen im Hippokampus ausgeschüttet. In diesem Zusammenhang ist es weiterhin wichtig zu erwähnen, dass der Hippokampus Andockstellen (Rezeptoren) für CRH besitzt.
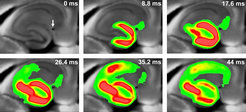
Die Arbeitsgruppe von Matthias Eder konnte erstmals nachweisen, dass schon sehr geringe Konzentrationen von CRH den neuronalen Aktivitätsfluss durch den Hippokampus von Mäusen deutlich steigern. Dieser Effekt blieb im Hippokampus von Mäusen, denen der CRH-Rezeptor Typ 1 fehlt, vollständig aus und wird also durch diesen Rezeptor vermittelt [1]. Offenbar führen dauerhaft erhöhte Konzentrationen von CRH im Gehirn während chronischem Stress zu einer dauerhaften Überaktivität des Hippokampus, was den den Zelltod von Neuronen zur Folge haben kann. Dies ist eine plausible Erklärung dafür, dass Depression und Angsterkrankungen vor allem dann mit einer Verschlechterung von Gedächtnisleistungen einhergehen, wenn depressive Episoden und Panikattacken nicht erfolgreich behandelt werden konnten.
Ausblick
Erste am Max-Planck-Institut für Psychiatrie mit der VSDI-Technik erhobene Befunde zeigen, dass VSDI eine erfolgversprechende Methode für die psychiatrische Grundlagenforschung ist. VSDI soll in Kürze dafür eingesetzt werden aufzuklären, inwieweit eine akute bzw. chronische Verabreichung von Antidepressiva den neuronalen Aktivitätsfluss durch Gehirnregionen verändert, die für affektive Störungen relevant sind. Dies sollte einen wichtigen Beitrag dazu leisten, besser zu verstehen, wie Antidepressiva ihre therapeutischen Wirkungen vermitteln. Des Weiteren ist geplant, mittels VSDI-Veränderungen neuronaler Netzwerkaktivität aufzudecken, die maßgeblich daran beteiligt sind, krankhafte Angstzustände auszulösen.

