Multiple Sklerose: Pathogenese und Möglichkeiten einer individualisierten Therapie
Forschungsbericht (importiert) 2006 - Max Planck Institut für Psychiatrie
Pathogenese der Multiplen Sklerose

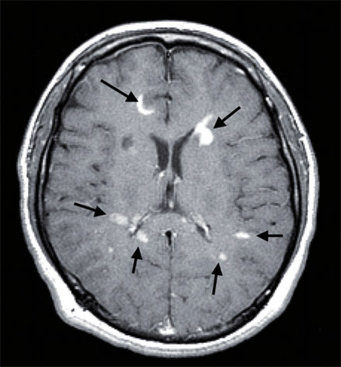
Die Multiple Sklerose (MS) ist eine chronisch entzündliche Erkrankung des zentralen Nervensystems, die zu einer Demyelinisierung führt, das heißt zur Zerstörung der Myelinscheide der Nervenzellen sowie der Nervenzellen selbst. Sie zählt zu den häufigsten neurologischen Erkrankungen junger Erwachsener und weist eine große Variabilität hinsichtlich des Krankheitsverlaufs auf. Klinisch lassen sich schubförmig-remittierende von primär und sekundär progredienten (fortschreitenden) Verläufen unterscheiden. Die klinische Symptomatik reicht von leichten Beeinträchtigungen der Beweglichkeit über schwere Behinderungen bis hin zum Tod der Betroffenen. Neben den neurologischen Symptomen leiden viele Patienten unter kognitiven Defiziten, einer besonderen Form der Erschöpfung („Fatigue“) und manifesten Depressionen. Pathologisch-anatomisch stellen entzündliche Infiltrate in Gehirn und Rückenmark das Substrat der Erkrankung dar. Diese „Herde“ lassen sich auch im Kernspintomogramm (MRT) nachweisen, weshalb dieser Untersuchungsmethode ein hoher Stellenwert in der Diagnose und bei der Verlaufsbeobachtung der MS zukommt (Abb. 1). Auffälligkeiten finden sich darüber hinaus sowohl im Immun- als auch im Hormonsystem. Der Entzündungsprozess führt z.B. zur Bildung von Immunglobulinen (IgG) im zentralen Nervensystem und zu einer veränderten Zytokinproduktion bei T-Lymphozyten [1]. Eine erhöhte Hormonproduktion der Hypothalamus-Hypophysen-Nebennieren-Achse (der sog. "Stressachse") zeigt bei MS-Patienten einen signifikanten Zusammenhang mit der Ausprägung der Fatigue [2].
Der Krankheitsverlauf, die radiologisch und gewebsanalytisch fassbaren Läsionen sowie das Ansprechen auf die vorhandenen Therapien sind jedoch sehr unterschiedlich und lassen auf eine komplexe Krankheitsentstehung schließen.
Trotz intensiver Forschungsanstrengungen in den letzten Jahrzehnten ist die Ursache der MS unbekannt. Die bisherigen Ergebnisse weisen auf eine genetische Disposition hin, jedoch auch auf einen erheblichen Einfluss von Umweltfaktoren. Eineiige Zwillinge zeigen eine Konkordanz von nur 30%. Große genetische Untersuchungen bestätigten eine Assoziation der Erkrankung mit einem immunrelevanten Gen, dem HLA-DR15 (DRB1.1501-DQB1.0602) Haplotyp im Haupthistokompatibilitätskomplex, jedoch konnte bisher kein weiteres Gen identifiziert werden, das sicher mit der MS assoziiert ist. Genetische Modelle lassen vermuten, dass es nicht das „MS-Gen“ gibt, sondern dass das Zusammenspiel mehrerer Gene für die genetische Prädisposition verantwortlich ist.
Die experimentelle allergische Encephalomyelitis als Tiermodell der MS
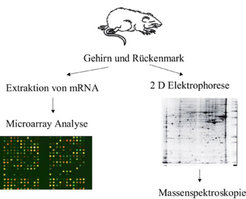
Bereits in der ersten Hälfte des vergangenen Jahrhunderts wurde nachgewiesen, dass im Tier durch Immunisierung mit Hirngewebe eine der MS ähnliche Erkrankung mit Lähmungen, Blasenstörungen und entzündlichen ZNS-Infiltraten ausgelöst werden kann, die sog. experimentelle allergische Encephalomyelitis (EAE). Später konnte gezeigt werden, dass diese Erkrankung von T-Zellen, jedoch nicht von Antikörpern übertragen wird. Neuerdings wurden transgene Tiere generiert, deren T- und B-Lymphozyten spezifisch ein Protein der Myelinscheide erkennen, welche die Nervenstränge umgibt – das sog. Myelin Oligodendrozyten Protein (MOG). Diese Tiere entwickeln spontan eine EAE. Anhand dieses Modells werden derzeit in Kooperation mit dem MPI für Neurobiologie in Martinsried pathogenetisch wichtige Faktoren und somit Ansatzpunkte für neue Therapien untersucht. Hierzu wird zusammen mit den Arbeitsgruppen um Jan Deussing und Bertram Müller-Myhsok die Microarray-Technologie angewandt, die es erlaubt, nahezu das gesamte Transkriptom der transgenen Tiere in verschiedenen klinisch und histopathologisch definierten Krankheitsstadien zu vergleichen. Unterschiede in der Proteinexpression und Phosphorylierung werden mithilfe der Proteomics-Technologie analysiert (Abb. 2).
Die Notwendigkeit einer maßgeschneiderten Therapie
Im letzten Jahrzehnt wurden mehrere Therapien für unterschiedliche Krankheitsverläufe der MS entwickelt. Als Basistherapie des schubförmig-remittierenden Verlaufs werden Interferon-ß (IFN-ß), Glatirameracetat, Immunglobuline und Azathioprin eingesetzt. Bei Versagen der Basistherapeutika oder primär hoher Krankheitsaktivität kommen Mitoxantron und seit kurzem Natalizumab zum Einsatz. Im sekundär chronisch progredientem Stadium besteht die Therapie in der Gabe von hochdosierten IFN-ß-Präparaten oder Mitoxantron. Für die primär chronisch progrediente Form steht derzeit keine etablierte medikamentöse Behandlung zur Verfügung. Doch auch die vorhandenen Therapieoptionen vermögen lediglich den Krankheitsverlauf zu verlangsamen. Eine Heilung ist nach wie vor nicht möglich. Aufgrund des sehr variablen klinischen Verlaufs ist meist eine Beobachtungszeit von ein bis zwei Jahren notwendig, um im Einzelfall die Wirksamkeit einer Therapie nachzuweisen. Bei der am häufigsten angewandten Therapie – der Behandlung mit IFN-ß – rechnet man mit ca. 30 % Therapieversagern. Allerdings ist es derzeit nicht möglich, die Wirkung einer der genannten Therapien für den individuellen Patienten vorherzusagen. Diese Prognose wäre jedoch von großer Bedeutung, unter anderem da jede Therapie mit Nebenwirkungen verbunden sein kann und durch lange Therapiedauer erhebliche Behandlungskosten entstehen.
Pharmakogenetik der MS
Im Grenzgebiet von genetischer und pharmazeutischer Forschung entwickelt sich mit der Pharmakogenetik ein neues Fachgebiet, dessen Ziel darin besteht, für jeden einzelnen Patienten maßgeschneiderte Arzneien und Therapien zu entwickeln, die eine bessere Wirkung bei geringeren Nebenwirkungen entfalten. Bislang beruhen sämtliche Aussagen über die Wirksamkeit eines Medikaments und über dessen Risiken auf statistischen Mittelwerten, die man in klinischen Prüfungen an einem großen Patientenkollektiv gewinnt. Seit Jahrzehnten ist jedoch bekannt, dass viele der häufig verordneten Medikamente zum Teil erhebliche interindividuelle Unterschiede hinsichtlich ihrer therapeutischen Wirkung und ihrer Nebenwirkungen aufweisen, die nicht mit bekannten Einflussfaktoren wie Alter, Körpermasse, Nieren- oder Leberfunktion erklärt werden können. Als Ursache einiger dieser Unterschiede konnten bereits genetische Merkmale identifiziert werden. Pharmakogenetiker suchen deshalb nach individuellen Erbmerkmalen, welche die Wirkung von Arzneimitteln beeinflussen. Wurden anfangs hauptsächlich genetische Unterschiede bei Enzymen entdeckt, die Arzneimittel abbauen, so sind heute auch Polymorphismen und genetische Varianten für andere wirkungsrelevante Prozesse bekannt, wie für die Absorption und Verteilung sowie für Transportproteine und Rezeptoren der Arzneimittel.
Während früher in einem hypothesengeleiteten Ansatz einzelne Gene oder Proteine analysiert wurden, die auf Grund bereits vorhandener Kenntnisse über die Erkrankung interessant erschienen, werden heute zunehmend empirische experimentelle Ansätze verfolgt. Ermöglicht wird dies u.a. durch die Sequenzierung des humanen Genoms und die Entwicklung von Hochdurchsatz-Verfahren, die es erlauben, eine sehr große Anzahl von Genen und Proteinen in vertretbarer Zeit und mit vertretbaren Kosten zu untersuchen.

Interindividuelle Basen-Unterschiede im Genom – bezeichnet als single nucleotide polymorphisms (SNPs) – sind mit Hochdurchsatz-Verfahren messbar. Außerdem können so eventuelle Assoziationen eines Allels mit Erkrankungen erkannt werden.
In Kooperation mit der Neurologischen Abteilung der Universität Würzburg und dem Institut für klinische Neuroimmunologie der LMU München – zusammen mit den Arbeitsgruppen um Manfred Uhr, Florian Holsboer und Bertram Müller-Myhsok – wurde eine Pilotstudie durchgeführt: 675 SNPs in 93 Genen von 54 MS-Patienten, die auf die Therapie mit IFN-ß ansprachen (Therapie-Responder) wurden mit 52 Patienten verglichen, die nicht von der Therapie profitierten (Therapie-Non-Responder). In diesem Kollektiv waren 35 SNPs in fünf benachbarten Genen mit dem Ansprechen auf die IFN-ß-Therapie assoziiert (Abb. 3). Zwei dieser Gene erhöhten auch die Wahrscheinlichkeit, überhaupt an MS zu erkranken. Diese Ergebnisse bedürfen allerdings noch der Replikation in einem unabhängigen Kontrollkollektiv. Aktuell wird untersucht, ob die identifizierten SNPs einen Einfluss auf die Regulierung der Gene unter IFN-ß-Therapie besitzen.
Untersuchungen des humanen Proteoms
Um die Pathogenese der MS zu verstehen, genügt es nicht, nur das Genom und das Transkriptom zu untersuchen, da ein starker Umwelteinfluss anzunehmen ist. Weil die Proteine den Phänotyp eines Organismus am besten repräsentieren, ist eine zusätzliche Untersuchung des Proteoms, das heißt der Gesamtheit aller Proteine eines Organismus, sinnvoll. Da pathogene T-Zellen im Tiermodell die Erkrankung auf syngene Tiere, d.h. Tiere des gleichen Inzuchtstammes übertragen können und die MS histopathologisch durch entzündliche Infiltrate im ZNS charakterisiert ist, wird aktuell in Zusammenarbeit mit der Arbeitsgruppe um Christoph Turck das Proteom autoreaktiver humaner T-Zellen und histopathologisch charakterisierter MS-Läsionen verglichen (Abb. 4). Erste Ergebnisse weisen auf Unterschiede in T-Zell-Linien verschiedener Antigenspezifität und zwischen ZNS-Läsionen hin, bei denen eine Regeneration der Markscheiden stattfindet bzw. diese ausbleibt. In Zukunft sollen die Untersuchungen auf den Liquor („Nervenwasser“) ausgeweitet werden.
Nervenwachstumsfaktoren

Bisher wurde in vielen Untersuchungen die entzündliche Komponente der MS in den Vordergrund gestellt. Auch zielen alle zur Verfügung stehenden Therapien auf eine Suppression der Entzündungsreaktion ab. Allerdings findet man bei chronisch progredientem Verlauf eine klinische Verschlechterung, ohne dass sich eine entsprechende Entzündungsaktivität nachweisen lässt. Außerdem kann eine Besserung der neurologischen Ausfälle nur durch eine Regeneration von geschädigten Neuronen erreicht werden. Nervenwachstumsfaktoren können die Regeneration geschädigter Neurone fördern, jedoch auch – wie neuere Untersuchungen zeigen – die Aktivität von Immunzellen modulieren. Hier scheinen insbesondere die „glial-derived-neurothrophic-factor (GDNF) family ligands (GFLs)“ interessant. Neurturin – ein Mitglied dieser Familie – moduliert die Tumor-Nekrose-Faktor-alpha-Produktion in Blutzellen. Möglicherweise hängt bei MS-Patienten die Neurturin-Produktion von den Stadien des Schubs und der Remission ab. Weitere Untersuchungen zum Nachweis anderer GFLs und deren Rezeptoren auf eingewanderten Entzündungszellen im Gehirn von MS-Patienten sind geplant.
Ausblick
Die am Max-Planck-Institut für Psychiatrie zur Verfügung stehenden Hochdurchsatz-Verfahren zur Erforschung des Genoms, Transkriptoms und Proteoms bieten erstmalig die Möglichkeit, die Pathogenese und Pharmakogenetik der MS empirisch, das heißt ohne hypothesengeleitete Annahmen über die pathophysiologische Relevanz einzelner Gene zu erforschen. Die Ergebnisse der pharmakogenetischen Pilotstudie zeigen die Durchführbarkeit dieses experimentellen Ansatzes, sodass im nächsten Schritt ein „whole genome“-Ansatz geplant ist. Weiterhin wird die Microarray-Technik auf humane Proben, in unserem Fall periphere Blutzellen, ausgedehnt, da sie vergleichsweise einfach verfügbar sind und in früheren Untersuchungen nachgewiesen wurde, dass sie den Krankheitsprozess der MS in gewissem Ausmaß reflektieren. Dieser empirische Ansatz ermöglicht überraschende und relevante Befunde für die Pathogenese und Therapie der MS.