Molekulare Neurogenetik
Genetische Risikofaktoren
Die kausalen Ursachen psychiatrischer Erkrankungen sind weitgehend unbekannt. Die Identifizierung von Risikogenen hat sich bislang als schwierig erwiesen, da viele Ergebnisse trotz der inzwischen vorhandenen technischen Möglichkeiten zur Durchführung genomweiter Assoziationsstudien (GWAS) nicht repliziert werden konnten. Dieser Misserfolg resultiert im Wesentlichen aus der phänotypischen und genetischen Heterogenität dieser Erkrankungen sowie aus der Schwierigkeit, Umweltfaktoren zu erfassen, die sich auf die Entstehung der Krankheiten auswirken. Jedoch werden sowohl die wachsende Zahl an genetisch charakterisierten Patienten als auch die Bestrebungen zukünftig komplette Genome zu sequenzieren, die statistische Aussagekraft signifikant erhöhen. Diese Ansätze haben das Potenzial, krankheitsrelevante Risikogene, betroffene Signalwege und sogar seltene kodierende Genvarianten mit größerer Effektstärke zu identifizieren.

Trotz der zuvor genannten Schwierigkeiten wurden in den letzten Jahren mit Hilfe humangenetischer Untersuchungen eine Reihe genetischer Varianten identifiziert, die mit psychiatrischen Erkrankungen assoziiert werden konnten (Fig. 1). Eine Einschränkung besteht derzeit darin, dass die meisten dieser Risikovarianten bislang nicht in vivo, d. h. in einem geeigneten Tiermodell, experimentell validiert werden konnten. Daher ist es unser Ziel, den Einfluss dieser Kandidatengene auf die Entstehung einer Erkrankung, insbesondere unter Berücksichtigung von Stress als Umweltfaktor, mit Hilfe geeigneter genetischer Mausmodelle zu untersuchen. Darüber hinaus können diese Mausmodelle dazu beitragen, das Potenzial der untersuchten Kandidatengene als Biomarker oder als neuartige pharmakologische Zielstrukturen für eine zukünftige therapeutische Intervention zu überprüfen.
Epigenetische Mechanismen
Trotz überzeugender epidemiologischer Beweise für die Erblichkeit psychiatrischer Erkrankungen wurde bisher nur eine geringe Anzahl genetischer Risikofaktoren identifiziert. Dieses Phänomen, das als „missing heritability“ bezeichnet wird, kann bis zu einem gewissen Grad durch die Limitierung der derzeitigen genetischen Ansätze erklärt werden (s. o.). Jedoch mehren sich die Hinweise darauf, dass epigenetische Mechanismen eine bedeutende Rolle spielen könnten.
Der Begriff „Epigenetik“ bezeichnet stabile Veränderungen der Genaktivität, die auf Modifikationen in der Chromatinstruktur beruhen (z. B. DNA-Methylierung oder Modifizierungen von Histonen), unabhängig von einer Veränderung der primären DNA-Sequenz. Solche epigenetischen Veränderungen können durch Umwelteinflüsse hervorgerufen werden, die auf diesem Wege direkt mit der genetischen Ausstattung des Individuums zusammenwirken und somit das Krankheitsrisiko beeinflussen.
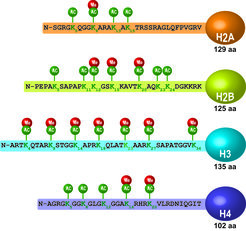
Es gibt umfangreiche Belege dafür, dass eine veränderte Chromatin-Plastizität an psychiatrischen Erkrankungen beteiligt ist. Histon-Deacetylase (HDAC)-Inhibitoren können z. B. Depressionssymptome im Menschen und in entsprechenden Mausmodellen lindern. Darüber hinaus wurde gezeigt, dass Stressoren das Epigenom direkt beeinträchtigen, indem sie die Histon-Acetylierung verändern (Fig. 2). Diese Beobachtungen eröffnen neue Wege für ein besseres Verständnis der Pathophysiologie stressbedingter Erkrankungen. Daher beabsichtigen wir, die Auswirkungen von HDACs auf emotionales Verhalten, kognitive Leistung und Stressreaktion zu untersuchen. Diese Parameter werden mit Veränderungen der Genaktivität und genomweiten Acetylierungsmustern im Gehirn korreliert, um mögliche schützende oder schädliche Effekte der HDACs auf die Stressantwort besser verstehen zu können.
Neuronale Stress-Netzwerke
Neben genetischen und epigenetischen Faktoren spielen vermutlich Fehlfunktionen neuronaler Netzwerke bei der Entstehung neuropsychiatrischer Erkrankungen eine Rolle. Neuronale Netzwerke sind funktionale Einheiten von Zellen des Gehirns, die komplexe Prozesse wie Gedanken, Gefühle oder Verhalten steuern. Entwicklung, Struktur sowie funktionale Integrität und Dynamik dieser Netzwerke unterliegen ihrerseits einer Kontrolle durch genetische und epigenetische Faktoren.
Das neuronale Netzwerk um das Corticotropin-Releasing Hormone (CRH) stellt den Prototypen eines neuronalen Stress-Netzwerks dar und ist ideal positioniert, um Gen × Umwelt Interaktionen zu vermitteln. Fehlanpassungen des CRH-Systems stehen im kausalen Zusammenhang mit der Entstehung stressbedingter neuropsychiatrischer Störungen wie Gemütsstörungen und Angsterkrankungen. CRH spielt eine entscheidende Rolle bei der Kontrolle von neuroendokrinen, autonomen und Verhaltens-Antworten auf Stress. Um diese Anforderungen zu erfüllen, übt CRH eine Doppelfunktion aus, indem es sowohl die Freisetzung von Stresshormonen im Rahmen der Hypothalamus-Hypophysen-Nebennierenrinden-Achse reguliert, als auch die Aktivität von Neuronen im Gehirn außerhalb des Hypothalamus moduliert.

Während die CRH-abhängige Kontrolle der neuroendokrinen Stressantwort weitestgehend verstanden ist, haben wir gerade erst begonnen, die Komplexität der CRH/CRH Rezeptor (CRHR) Netzwerke außerhalb des Hypothalamus zu verstehen, welche die Verhaltensreaktion auf Stress maßgeblich kontrollieren (Fig. 3). Wir verwenden „Werkzeuge“ der Mausgenetik, um die in vivo Funktion der Komponenten des CRH Systems, d. h. der Liganden (CRH, UCN1, UCN2, UCN3) und ihrer Rezeptoren (CRHR1, CRHR2), zu untersuchen. Indem wir konditionale (d. h. räumlich und zeitlich kontrollierte) Ansätze verwenden, untersuchen wir selektiv die netzwerkspezifischen Funktionen des CRH Systems. Darüber hinaus setzen wir diese genetischen Mausmodelle Umwelteinflüssen aus, die es uns ermöglichen, Mechanismen der Gen × Umwelt Interaktion zu untersuchen.
Eine künftige Herausforderung besteht darin, die Bedingungen und Mechanismen der Freisetzung von Neuropeptiden und der Rezeptoraktivierung in vivo zu verstehen. Letztendlich beabsichtigen wir, die CRH/CRHR-abhängigen Signalwege zu entschlüsseln, indem wir zum einen das CRHR1 Interaktom, d. h. die Gesamtheit der Proteine, die mit dem CRHR1 interagieren, entschlüsseln und zum anderen CRH/CRHR-abhängige Anpassungen des Transkriptoms und Proteoms untersuchen. Diese Bestrebungen werden unser Verständnis des zentralen Stress-Systems des Organismus voranbringen und wertvolle Erkenntnisse zur Verbesserung CRHR-basierter Behandlungsstrategien liefern.


